12 Das Atom
Die historische Entwicklung der Atommodelle
Die historische Entwicklung der Atommodelle zeigt, wie physikalisches Wissen entworfen, überprüft, verworfen, verfeinert oder neu entworfen wird.
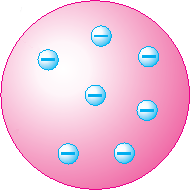
Das Rosinenkuchenmodell von Joseph John Thomson stellte das Atom als Kugel aus elektrisch positiver Materie mit eingebetteten Elektronen dar. |
 |
Streuversuche von Rutherford (1911) legten nahe, einen sehr dichten, elektrisch positiven Atomkern und Elektronen außerhalb dieses Kernes anzunehmen. |
 |
Niels Bohr ordnete den Elektronen auf der Basis von quantenhysikalischen Überlegungen Quantenzahlen zu und forderte, dass Elektronen nur in bestimmten Bereichen um den Atomkern auftreten könnten. |
|
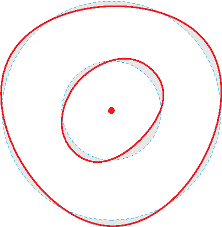
Um den Atomkern "sausende" Elektronen müssten in kurzer Zeit ihre gesamte Bewegungsenergie als elektromagnetische Welle abgestrahlen. Das Konzept von stehenden Elektronenwellen im Atom (Louis de Broglie) erklärt die Elektronen als statisches Gebilde um den Atomkern. |
 |
Im Orbitalmodell (Schrödinger, Pauli et al.) wird der Ort der Elektronen im Atom durch die Wahrscheinlichkeit angegeben, mit der ein Elektron ein einem bestimmten Bereich anzutreffen ist. Mit Hilfe von Quantenzahlen und mit dem Pauli-Prinzip kann die Form eines Atoms und die räumliche Ausrichtung von Bindungen ungefähr angegeben werden. |

|
Aufgaben
- Recherchiere zu Joseph John Thomson, Ernest Rutherford, Niels Bohr, Max Planck, Albert Einstein, Louis de Broglie, Wolfgang Pauli, Max Born und Erwin Schrödinger! Was sind ihre Beiträge zur Entwicklung des Atommodells?
- Recherchiere zum Thomson'schen Atommodell, Rutherford'schen Atommodell, Bohr'schen Atommodell, Atommodell von de Broglie und zum Orbitalmodell!